P450酶因含有血红素且能催化各式各样不同反应被称为“红色万能酶”,通过酶催化可取代日益严重的各种药物、化学品生产时造成的环境污染问题。但是自P450酶被发现数十年来,其晶体结构一直没能被解析出来,“万能”酶完整的催化机理一直困扰着科学界。近日,湖北大学生命科学学院、省部共建生物催化与酶工程国家重点实验室的陈纯琪教授团队,和马立新教授、郭瑞庭教授成功破解难题,在P450酶完整催化机理的研究方面取得重要突破,该研究成果在最新一期国际权威期刊《自然·通讯》上发表。
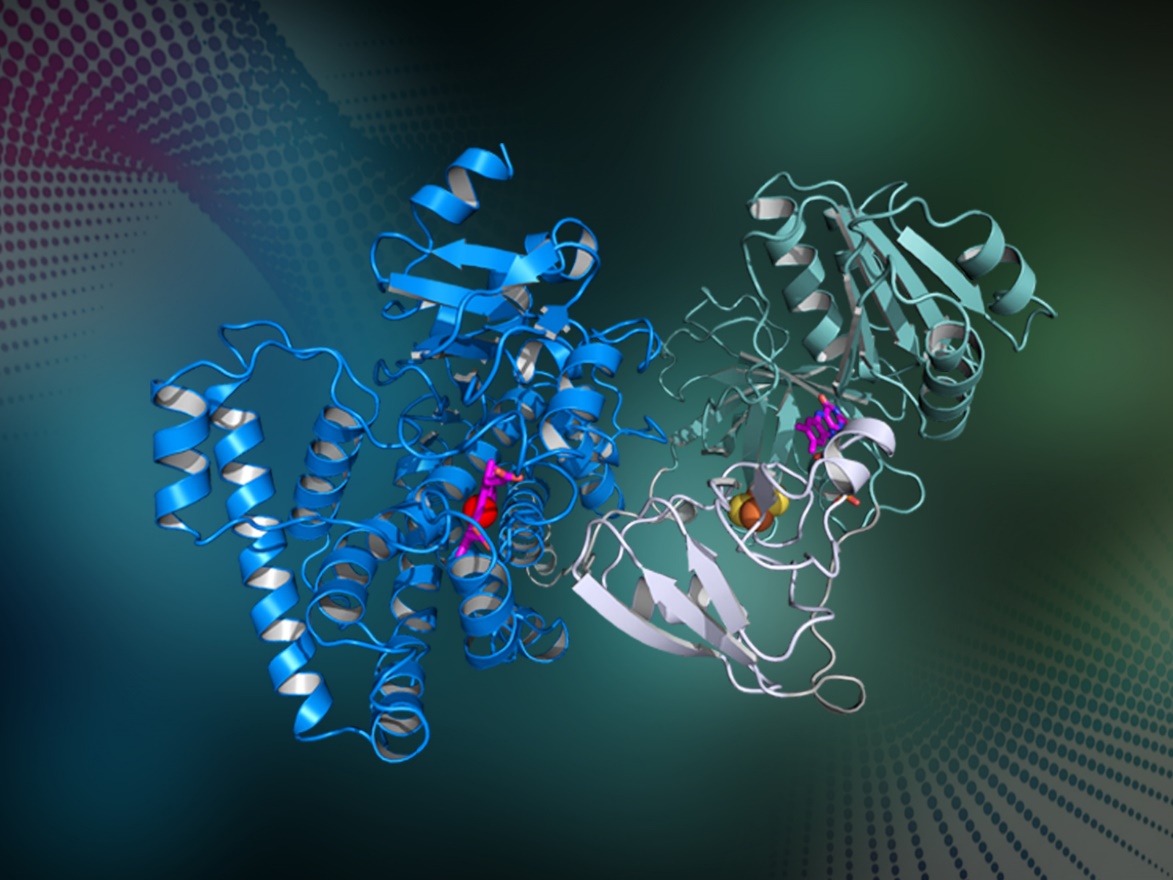
图片说明:自给自足P450酶的完整结构,蓝色为血红素结合区,青绿色为还原酶结构域,白色为铁氧还原蛋白结构域。(图片由受访者提供)
难识P450酶真面目,解密遭遇瓶颈
“自然界中存在非常多不同种类的P450酶,它们参与细胞的生理调控、药物代谢以及许多重要药物的合成。”陈纯琪介绍,比如我们人类的染色体上就带有超过50个P450酶的基因,它们负责胆固醇、固醇类激素和维生素D等重要化合物的合成;许多具有药物活性的植物或微生物次级代谢物 (如青蒿素、紫杉醇),也是由P450酶负责催化合成的;还有一些药物的化学结构非常复杂,单纯以人工合成的方法生产大量高纯度的药物极为困难,只有酶才能够精准调控复杂的合成途径。
科学家们发现,P450酶能够识别多种底物,由此利用基因工程改造P450酶来量身订制化学反应,成为一个热门研究方向。2018年诺贝尔化学奖得主阿诺德教授就是利用改造P450酶来进行各种困难或者特殊的化学反应。
一个完整的P450酶系统由三个部件组成:带有血红素的底物结合区;负责产生电子的还原酶;连接底物结合区和还原酶的通道。“这就像一个电器需要插上电才能工作,带有血红素的底物结合区就像电器本身,供电的插座就像还原酶,而电线就是连接两端的电子通道。”陈纯琪介绍,在建立一个P450酶反应系统时需要把所有组件都找齐了,组装在一起后才能够进行催化反应。有一些三种组件都串联在一起的P450酶,称作“自给自足P450酶”,这样的系统不需要另外寻找相匹配的供电器与电线,因此在应用的时候有巨大优势,也是方便科学家们研究的“明星P450酶”。
P450酶的血红素结合区识别底物机制的研究已经相当成熟,针对底物结合区的改造工程也有非常多的研究报道,但是对于电子如何从还原酶送入活性中心却仍有许多未知之处。要想知道电子是如何送入活性中心的路径,最直接的方法就是获得P450酶的晶体结构,这也等于完全看到酶的长相了。由于全长P450酶的蛋白质结晶困难,因此从1980年有了第一个P450酶的底物结合区晶体结构后,国内及国际上一直没有任何突破。
“看”清全长结构,摸清P450酶催化路径
陈纯琪教授带领的结构生物学研究团队,利用先进的X光晶体学技术,成功解析了“自给自足P450酶”的高分辨率完整的全长结构。
“我们经过研究发现,整个P450酶的三个组成部件, 从基因序列的排序依序为: 血红素结合区—还原酶结构域—铁氧还蛋白结构域。这三个区域各带有一个辅因子,分别是血红素、黄素单核苷酸、[二铁二硫],这三个辅因子也是P450酶内部电子传递时所需的中转站。电子传递就像送快递一样,需要经过几个中转站。”陈纯琪介绍,晶体结构显示,血红素结合区和还原酶分别位于整个蛋白质的两端,血红素结合区这一端朝外,露出开口以方便底物进入,而电子传递经过几个中转站,最终成功送达到血红素进行酶催化反应。
“黄素单核苷酸到[二铁二硫]的直线距离较近,为7.9埃(1纳米等于10埃),这样的距离电子可以直接传递过去。但[二铁二硫]和血红素的直线距离则长达 25.3 埃,超过直接电子能传递的距离。但是[二铁二硫]与血红素之间没有其他的氧化还原中心存在来协助传送电子。”陈纯琪解释道,科研人员观察到中间有许多的氨基酸,这些氨基酸可能辅助电子从[二铁二硫]传送到血红素。后续针对这些氨基酸进行突变验证,果真证实了其中几个氨基酸确实对于P450酶的电子传递很重要。
根据这些结果, 关于P450酶的电子如何从黄素单核苷酸通过[二铁二硫],传送到血红素的合理通路被完整的阐释。这也是迄今为止国内外首次解析“自给自足P450酶”的全长三维结构,是一个非常重要的里程碑,对于其他各类P450酶的改造与应用具有重要指导意义。
陈纯琪表示,其研究团队目前正利用所获得的结构学信息,加速对P450酶进行更加深入的理性设计改造,以期培育出能催化更多重要反应的新酶,早日实现P450酶的绿色生物工艺制造,并应用于生物科技、制药工程与化工产业。
