化学所发展线粒体自噬过程的新探针和干预自噬过程的新策略
作为细胞应激响应的保护机制,自噬在肿瘤发展中发挥重要作用。自噬降解细胞内物质可为肿瘤细胞快速增殖提供营养,同时自噬的活化还会促进肿瘤的转移。以自噬为靶点设计化学干预分子,抑制肿瘤细胞生长和转移,不仅可以克服常规癌症治疗时肿瘤细胞产生的抗药性和抗凋亡性,而且可以招募免疫因子,从而进一步增强肿瘤治疗效果,因此近年来备受关注。
在国家自然科学基金委、科技部和中国科学院的支持下,中科院化学研究所有机固体重点实验室研究员张德清课题组和活体分析化学重点实验室研究员赵睿课题组合作,近年来开展了以四苯乙烯为关键骨架的肿瘤靶向荧光分子设计,取得了系列进展。设计合成了具有肿瘤细胞特异性的探针分子,建立了成像指导下的肿瘤治疗新方法(Chem. Eur. J. 2014, 20, 158-164; Anal. Chem. 2014, 86, 7987-7995; Anal. Chem. 2016, 88, 6374-6381; Chem. Commun. 2017, 53, 11091-11094),发现阴离子的改变可以调控分子聚集体的尺寸、荧光发射和表面性质,进而可实现肿瘤细胞选择性、穿透能力和亚细胞定位的调节,实现了肿瘤细胞的高效杀伤(Chem. Sci. 2016, 7, 7013-7019)。
最近,他们设计合成了具有不同长度烷基侧链的四苯乙烯吡啶盐分子,发现这些分子可以与血液中的白蛋白自发组装形成复合物,并通过血液循环靶向定位到肿瘤组织。进一步研究发现,随着烷基链长度的增加,分子与白蛋白(albumin)疏水空腔的结合力增强,对肿瘤细胞的线粒体定位能力也增强。更为重要的是,分子定位到线粒体后对线粒体产生氧化损伤,导致线粒体发生肿胀变形。生物透射电镜和荧光自噬指示分析证明,分子不仅导致肿瘤细胞内自噬小体(autophagosome)的累积,而且抑制了自噬小体与溶酶体的融合,使自噬通路受阻,最终导致肿瘤细胞死亡。他们利用荷瘤小鼠模型,示踪定位了分子穿透到肿瘤内部进行富集的特点;通过自噬干预的新途径,对高恶性度的脑肿瘤实现了有效抑制(如图)。研究成果近日发表于《德国应用化学》(Angew. Chem. Int. Ed. 2020, doi: 10.1002/anie.202001906),并被选为Frontispiece,通讯作者是张德清和赵睿,第一作者是副研究员黄嫣嫣。
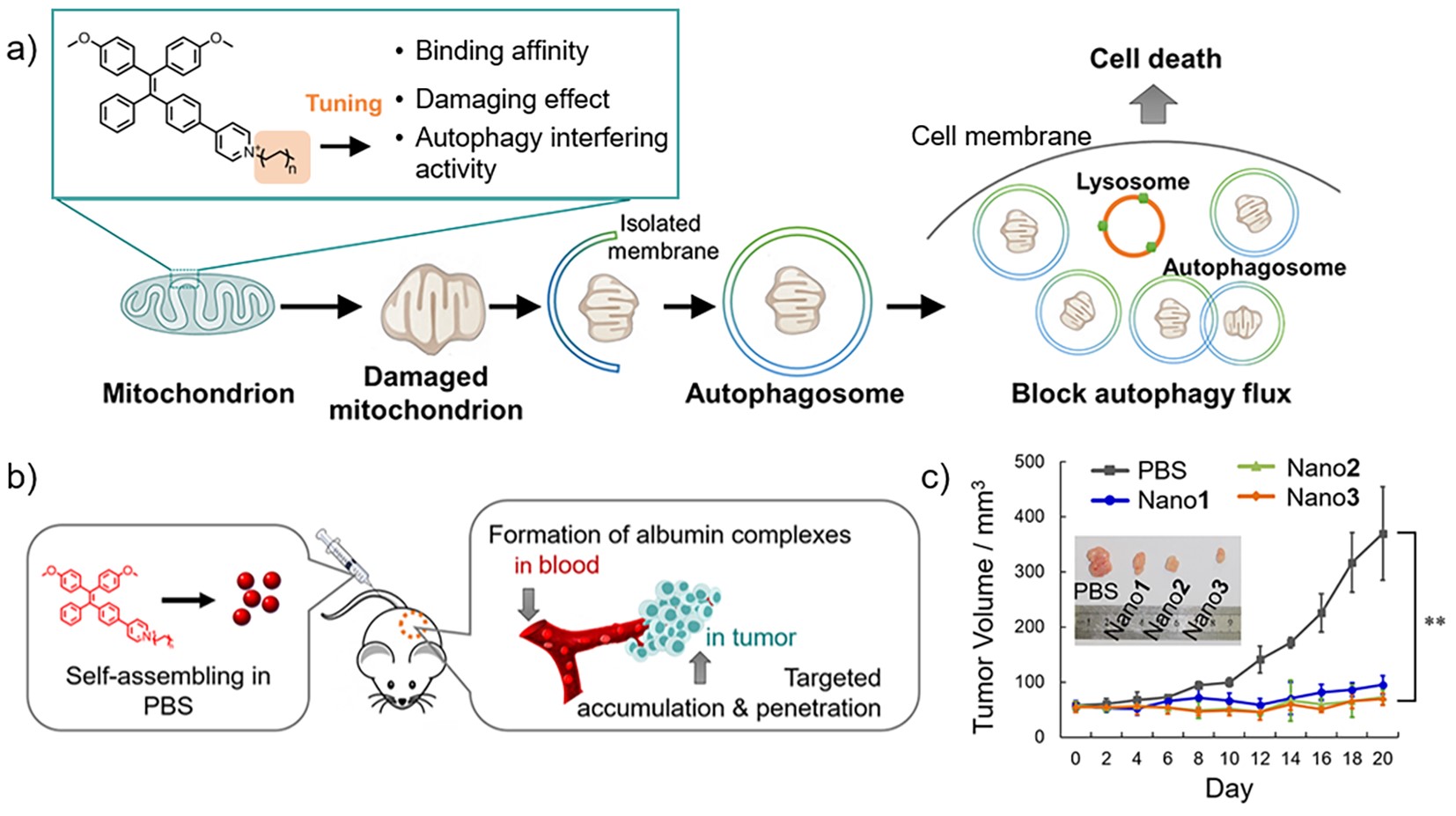
图:四苯乙烯吡啶盐通过干预线粒体自噬过程抑制恶性肿瘤
|
|

官方微信